नाइट्रेट र नाइट्राइट बीचको मुख्य भिन्नता यो हो कि नाइट्रेटमा नाइट्रोजन एटममा बाँडिएको तीन ओक्सीजन परमाणुहरू हुन्छन् जबकि नाइट्राइटमा नाइट्रोजन एटममा बाँधिएको दुई ओक्सीजन परमाणुहरू हुन्छन्।
नाइट्रेट र नाइट्राइट दुबै नाइट्रोजन र अक्सिजन परमाणुहरू मिलेर अकार्बनिक आयनहरू हुन्।यी दुबै आयनहरूमा -1 विद्युतीय चार्ज छ।तिनीहरू मुख्यतया नुन यौगिकहरूको आयोनको रूपमा देखा पर्दछ।नाइट्रेट र नाइट्राइट बीच केही भिन्नताहरू छन्;हामी यस लेखमा ती भिन्नताहरू छलफल गर्नेछौं।
नाइट्रेट के हो?
नाइट्रेट रासायनिक सूत्र NO3– भएको अकार्बनिक आयन हो।यो एक polyatomic anion छ जसमा 4 परमाणुहरू छन्;एक नाइट्रोजन परमाणु र तीन अक्सिजन परमाणु।एनियनसँग -1 समग्र चार्ज छ।यस anion को मोलर मास 62 g/mol छ।साथै, यो आयन यसको कन्जुगेट एसिडबाट व्युत्पन्न हुन्छ;नाइट्रिक एसिड वा HNO3।अर्को शब्दमा, नाइट्रेट नाइट्रिक एसिडको संयुग्मित आधार हो।
संक्षेपमा, नाइट्रेट आयनको केन्द्रमा एक नाइट्रोजन परमाणु हुन्छ जुन सहसंयोजक रासायनिक बन्धन मार्फत तीन ओक्सीजन परमाणुहरूसँग बाँध्छ।यस आयोनको रासायनिक संरचनालाई विचार गर्दा, यसमा तीन समान NO बन्डहरू छन् (एनियनको अनुनाद संरचना अनुसार)।तसर्थ, अणुको ज्यामिति त्रिकोणीय समतल हो।प्रत्येक अक्सिजन एटमले −2⁄3 चार्ज बोक्छ, जसले आयोनको समग्र चार्ज -1 को रूपमा दिन्छ।
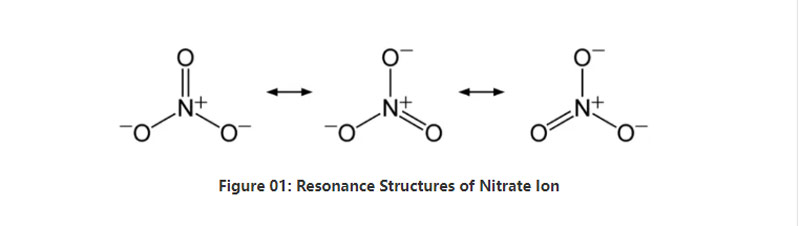
मानक दबाब र तापक्रममा, यो आयोन भएको लगभग सबै नुन यौगिकहरू पानीमा घुलन्छन्।हामी पृथ्वीमा प्राकृतिक रूपमा हुने नाइट्रेट लवणहरू भण्डारको रूपमा फेला पार्न सक्छौं;नाइट्रेटिन निक्षेप।यसमा मुख्यतया सोडियम नाइट्रेट हुन्छ।यसबाहेक, नाइट्रिफाइङ ब्याक्टेरियाले नाइट्रेट आयन उत्पादन गर्न सक्छ।नाइट्रेट लवणको प्रमुख प्रयोगहरू मध्ये एक मलको उत्पादनमा छ।यसबाहेक, यो विस्फोटक पदार्थहरूमा अक्सिडाइजिङ एजेन्टको रूपमा उपयोगी छ।
नाइट्राइट के हो?
नाइट्राइट रासायनिक सूत्र NO2– भएको अकार्बनिक नुन हो।यो आयन एक सममित आयन हो, र यसमा एक नाइट्रोजन एटम दुईवटा अक्सिजन परमाणुहरूमा बाँडिएको छ जसमा दुई समान NO सहसंयोजक रासायनिक बन्धहरू छन्।तसर्थ, नाइट्रोजन परमाणु अणुको केन्द्रमा छ।एनियनसँग -1 समग्र चार्ज छ।
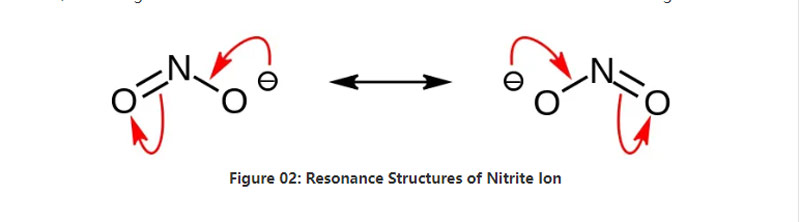
आयन को मोलर मास 46.01 g/mol छ।साथै, यो आयन नाइट्रस एसिड वा HNO2 बाट व्युत्पन्न हुन्छ।तसर्थ, यो नाइट्रस एसिडको संयुग्मित आधार हो।त्यसकारण, हामीले नाइट्रस धुवाँलाई जलीय सोडियम हाइड्रोक्साइड घोलमा पारेर औद्योगिक रूपमा नाइट्राइट लवण उत्पादन गर्न सक्छौं।यसबाहेक, यसले सोडियम नाइट्राइट उत्पादन गर्दछ जुन हामी पुन: स्थापना मार्फत शुद्ध गर्न सक्छौं।यसबाहेक, सोडियम नाइट्राइट जस्ता नाइट्राइट लवणहरू खाना संरक्षणमा उपयोगी छन् किनभने यसले खानालाई माइक्रोबियल वृद्धिबाट रोक्न सक्छ।
नाइट्रेट र नाइट्राइट बीच के भिन्नता छ?
नाइट्रेट रासायनिक सूत्र NO3- भएको अकार्बनिक आयन हो जबकि नाइट्राइट रासायनिक सूत्र NO2- भएको अकार्बनिक नुन हो।त्यसकारण, नाइट्रेट र नाइट्राइट बीचको प्राथमिक भिन्नता दुई एनियनहरूको रासायनिक संरचनामा हुन्छ।त्यो हो;नाइट्रेट र नाइट्राइट बीचको मुख्य भिन्नता यो हो कि नाइट्रेटले नाइट्रोजन एटममा बाँडिएको तीन ओक्सीजन परमाणुहरू समावेश गर्दछ जबकि नाइट्राइटमा नाइट्रोजन एटममा बाँधिएको दुई ओक्सीजन परमाणुहरू हुन्छन्।यसबाहेक, नाइट्रेट आयन यसको कन्जुगेट एसिडबाट व्युत्पन्न हुन्छ;नाइट्रिक एसिड, जबकि नाइट्राइट आयन नाइट्रस एसिडबाट व्युत्पन्न हुन्छ।नाइट्रेट र नाइट्राइट आयनहरू बीचको अर्को महत्त्वपूर्ण भिन्नताको रूपमा, हामी भन्न सक्छौं कि नाइट्रेट एक अक्सिडाइजिंग एजेन्ट हो किनभने यसले मात्र कटौती गर्न सक्छ जबकि नाइट्राइटले अक्सिडाइजिंग र कम गर्ने एजेन्टको रूपमा कार्य गर्न सक्छ।
पोस्ट समय: मे-16-2022





